こんにちは、aokuookikuです。
最近息子がバイバイを覚えましたが、仕事に行く時は朝ごはんの時間なので、バイバイよりもご飯のことで頭いっぱいで、バイバイはしません。#食べ盛り
今回は、「共有結合」についてまとめておきたいと思います。
前回の「イオン結合」に続き、物質の性質を決定する「粒のつながり方」の一つです。
少し詳細に書いていきます。

では、いきましょう。
復習
何と何を結びつけるか
まず、共有結合とは、何と何を結びつける方法かというと、
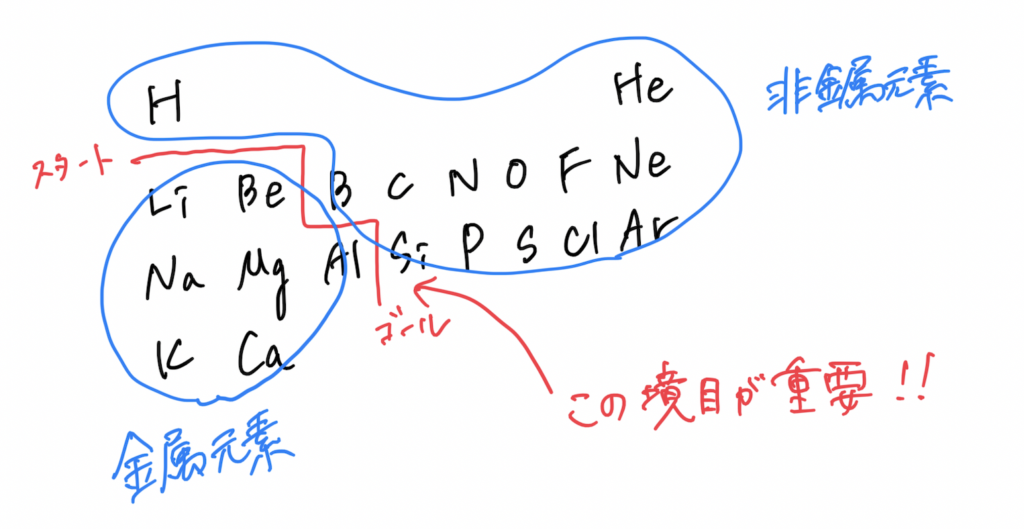
非金属元素と非金属元素を結びつける方法です。
さまざまな元素がある中で、金属元素と非金属元素の見分け方は↓
どう結びつけるか
その原理は以下の通りです。
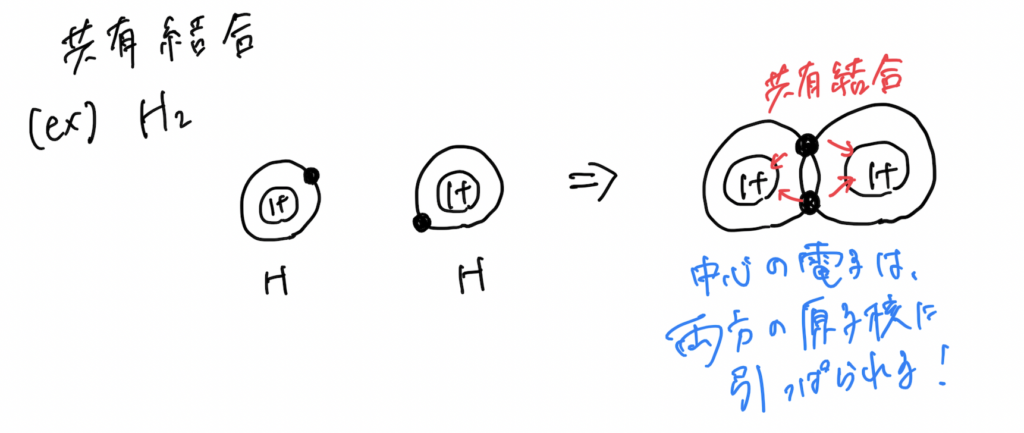
文章でまとめると、
各原子の最外殻電子を共有し、それを互いの原子殻が引きつけることで繋がります。
電子式
非金属元素同士がどのように結合しているかを考えるときに、
上記のように電子配置を1から書いていくには非常に手間です。
科学者は、基本面倒くさがりなので、より端的にわかりやすい考え方を作り出します。#これぞ知恵
そこで、作られた考え方が電子式です。
電子式の書き方は次の流れです。
①原子の価電子の数を把握する。
②それを元素記号の周りに・(ドット)で配置していく。
です。
1つずつ見てみましょう。
①原子の価電子の数を把握する。
共有結合は、価電子を他の原子と共有することで結合を作るので、
各原子の価電子数を正確に把握しておく必要があります。
そのためには、↓を使います。

そうです、周期表です。縦の並び(これを族という)では価電子数は同じですので、
下の赤字がその上にある原子の価電子数になります。
水素Hなら1つ、炭素Cなら4つですね。
②それを元素記号の周りに・(ドット)で配置していく。
この価電子を原子の記号の周りに配置すると、電子式の完成です。
例えで、窒素Nのものを書いてみると、
窒素の価電子数は5つです。
まず、記号の上下左右に4部屋あると思ってください。この部屋に電子を・(ドット)で配置していきます。
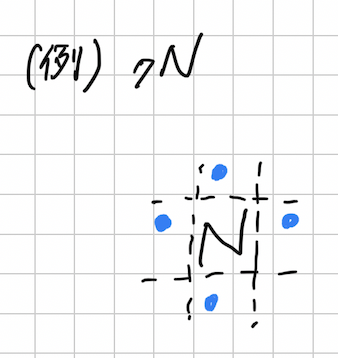
ここでのポイントは、なるべく対(ペア)にならないように配置することです。
ただ、4つの部屋に1つずつ配置して5つ目からは仕方なくペアにしていきます。

電子式で分子を描く
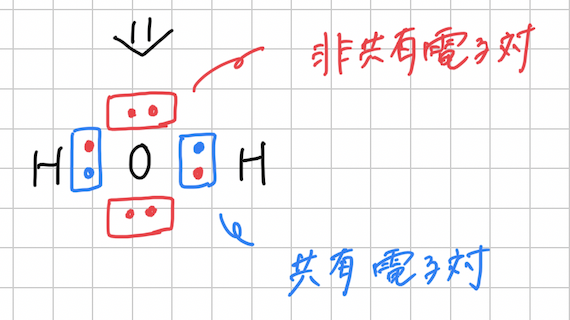
電子式を用いると、分子は次のように描かれます。
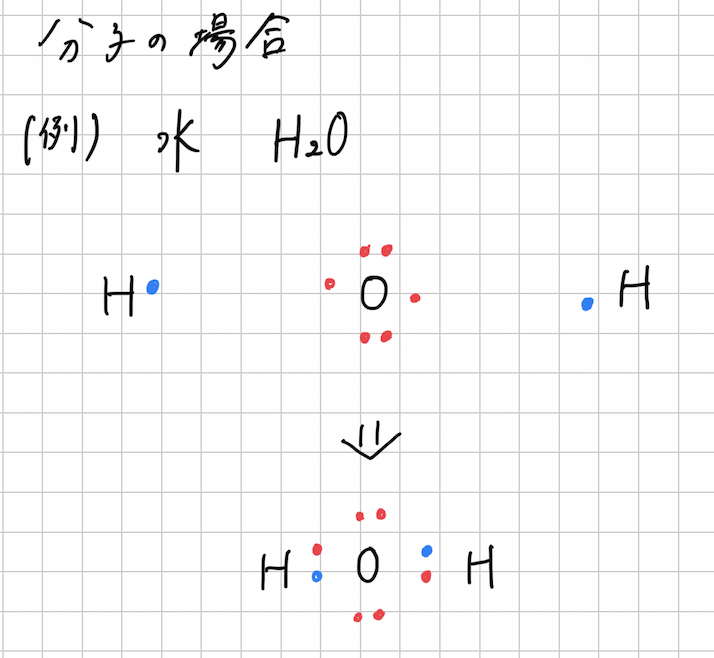
水H2Oの電子式を見たときに、酸素原子が他のどの原子とも共有していないものを、非共有電子対
他の原子と共有しているものを共有電子対といいます。
もう1つ例を見てみましょう。二酸化炭素CO2です。
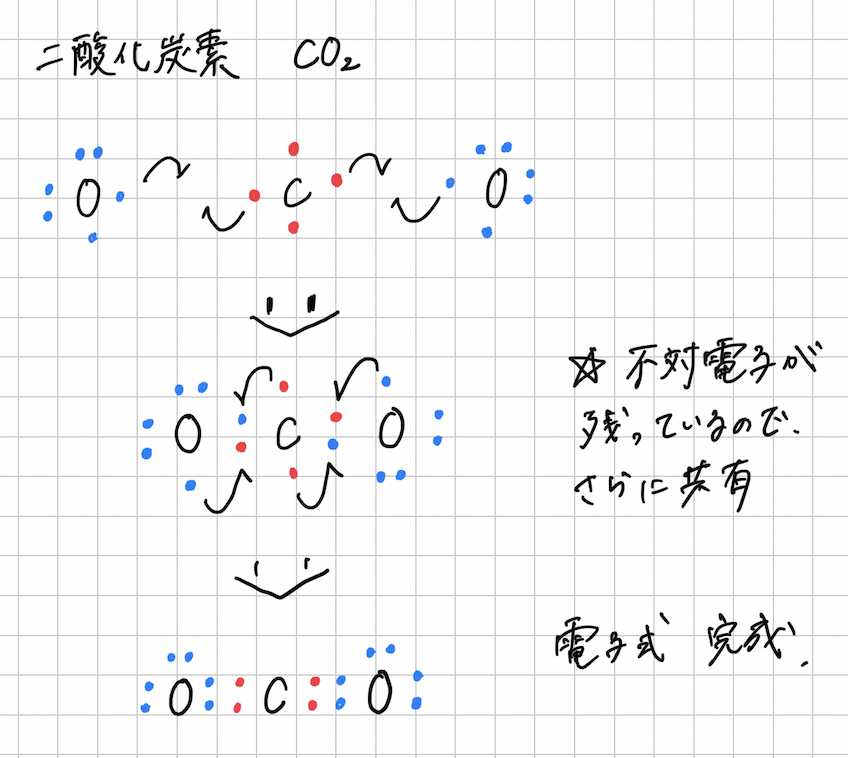
不対電子は、最終的に必ず残らないように結合するので、
パズルのように考えていけば、原子がどのように繋がっていくか、
電子式から予測することもできます。
構造式
電子式からさらに、・(ドット)を書くことも面倒になったところで、
さらに簡易に共有結合を表す方法が構造式です。
構造式では、共有電子対1つにつき、価標という棒線で表します。
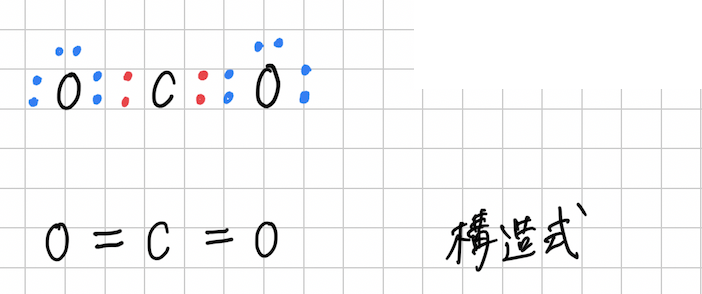
価標1本で繋がっている場合、単結合
2本の場合、二重結合
3本の場合、三重結合と呼びます。
今回はここまでに、しておきます。
共有結合関係は、もう少しあるので、それは次の回で。
では、また。

コメント
コメント一覧 (3件)
[…] あわせて読みたい 化学基礎 no.9 ①基礎の化学〜共有結合〜 こんにちは、aokuookikuです。 最近息子がバイバイを覚えましたが、仕事に行く時は朝ごはんの時間なので、バイバイよ […]
[…] あわせて読みたい 化学基礎 ①基礎の化学〜共有結合〜 こんにちは、aokuookikuです。 最近息子がバイバイを覚えましたが、仕事に行く時は朝ごはんの時間なので、バイバイよりもご […]
[…] あわせて読みたい 化学基礎 ①基礎の化学〜共有結合〜 こんにちは、aokuookikuです。 最近息子がバイバイを覚えましたが、仕事に行く時は朝ごはんの時間なので、バイバイよりもご […]