今回は、③酸・塩基の定義について書いていきたいと思います。
どんなものを酸と呼び、どんなものを塩基と呼ぶのか、はっきりさせておきましょう。
定義
酸・塩基の定義としては、次の3つがあることを知っておいてください。
①アレニウスの定義
②ブレンステッド・ローリーの定義
③ルイスの定義
それぞれのキーとなるものは、以下の通りです。
①H+とOH– ②H+ ③共有電子対
今回の記事では、①アレニウスの定義 ②ブレンステッド・ローリーの定義の2つを詳しく解説します。 ③ルイスの定義は、今のところ高校の化学の教科書には載っていない定義です。
*ただ、ルイスの定義は、模試や共通テストでは、誘導説明含みで、出題されることがありますので、知っておいて損はないと思います。自分で調べてみてください。
アレニウスの定義
酸・塩基について最初に定義したのが、アレニウスさんです。どのように定義したかというと、
酸・・・電離した際に、H+を生じるもの
塩基・・・電離した際に、OH–を生じるもの
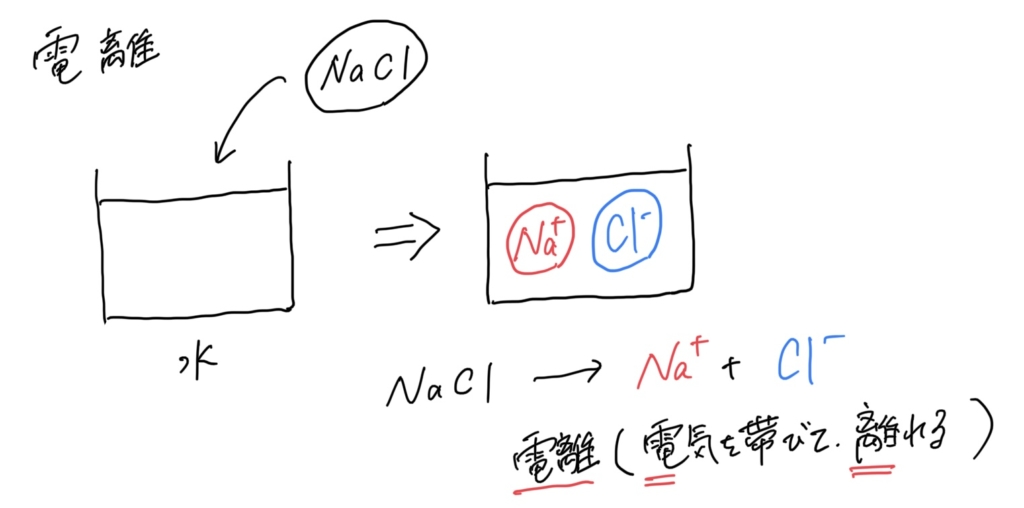
*電離←水溶液中(水に溶ける)で、陽イオンと陰イオンに分かれること。「電気を持って離れる」よって、電離と呼ぶ
(例)塩化ナトリウム NaCl → Na+ + Cl–
です。
必ず覚えておきたいものを厳選して、4つずつまとめておきます!
・酸
| 名称 | 化学式 | 電離式 |
| 塩化水素(塩酸) | HCl | HCl → H+ + Cl– |
| 硫酸 | H2SO4 | H2SO4 → 2H+ + SO42- |
| 硝酸 | HNO3 | HNO3 → H+ + NO3– |
| 酢酸 | CH3COOH | CH3COOH → H+ + CH3COO– |
基本的に、酸は化学式の頭にHがあり、それがちぎれてH+となる!
・塩基
| 名称 | 化学式 | 電離式 |
| 水酸化ナトリウム | NaOH | NaOH → Na+ + OH– |
| 水酸化カリウム | KOH | KOH → K+ + OH– |
| 水酸化カルシウム | Ca(OH)2 | Ca(OH)2 → Ca2+ + 2OH– |
| アンモニア | NH3 | NH3 + H2O → NH4+ + OH– |
基本的に、塩基は化学式のおしりにOHがあり、それがちぎれてOH–となる!
ブレンステッド・ローリーの定義
前述のアレニウスの定義では、「物質が電離する」というのが前提条件です。なので、電離しない物質は対象外になります。
せっかく「酸・塩基」という言葉を作ったならもっと汎用的に使いたいよね。ってことで定義を拡大する意味でもつくられたのが、ブレンステッド・ローリーの定義です。
ブレンステッド・ローリーの定義では、化学反応の中で、その物質が「酸として働いているか、塩基として働いているか」を定義しています。以下の通りです。
酸・・・H+を与えるもの(失う)
塩基・・・H+を受け取るもの
です。
例えば、塩化水素と水の反応は、次の化学反応式になります。
HCl + H2O → H3O+ + Cl–
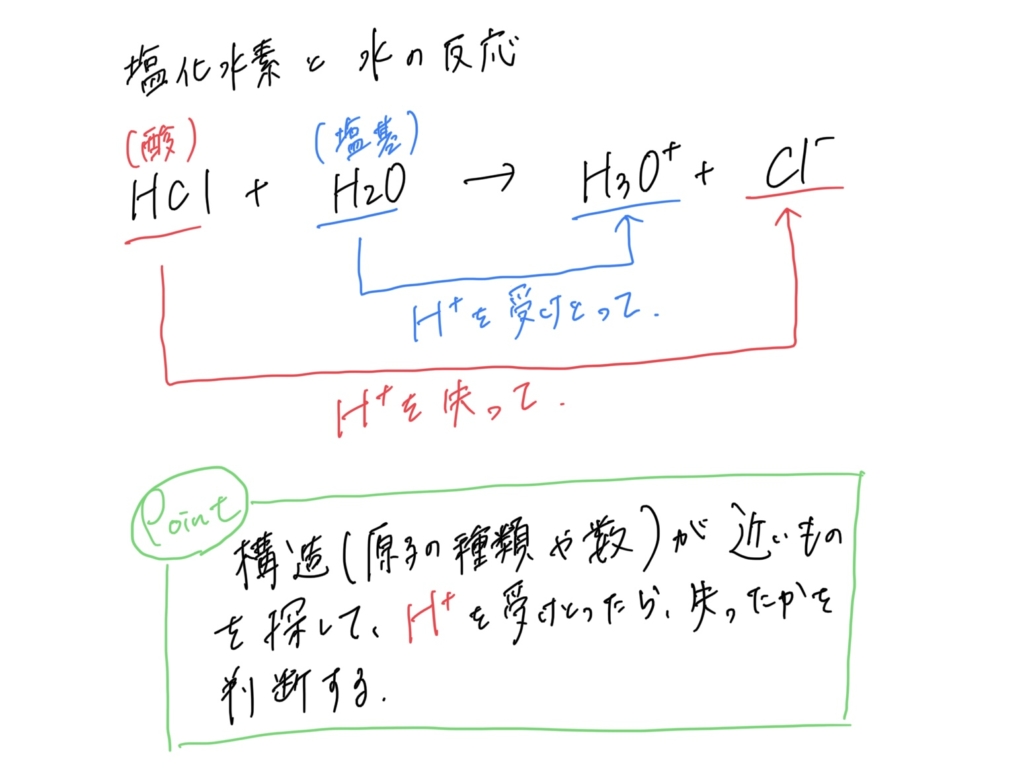
まとめると、この反応の中では、HClが酸として働き、H2Oが塩基として働いたということになります。
もう一つ例をあげます。
アンモニアと水の反応です。
NH3 + H2O → NH4+ + OH–
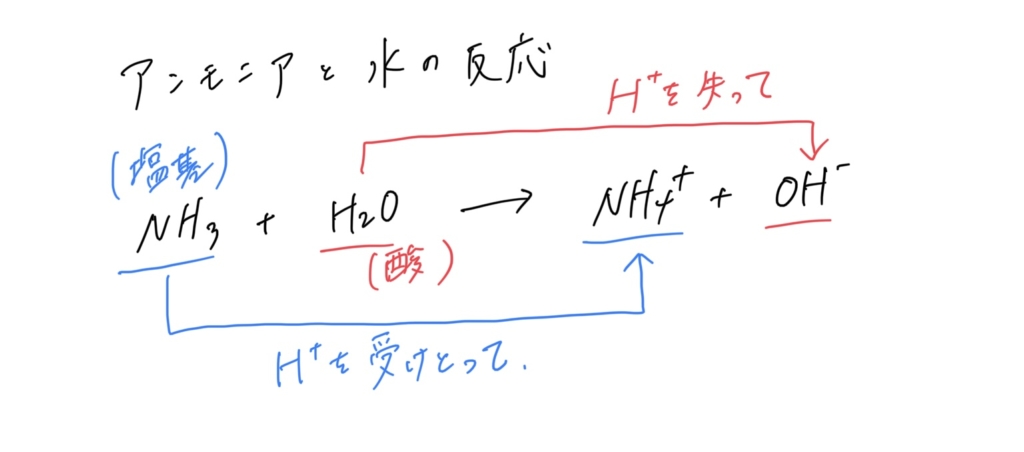
2つの事例からわかるように、ブレンステッド・ローリーの定義の場合は、同じ物質であっても、反応する相手によって、酸として働いたり、塩基として働いたりします。
決めつけで考えないようにしましょう。
最後に
以上が、酸・塩基の定義になります。
何が酸で、何が塩基か。ここがわかってないと、この単元は始まりません。
わからなくなったら、この記事に帰ってきて、確認する。「忘れたら、思い出す」これが学習の王道です。
また、一緒に勉強しましょう。


コメント