今回は、酸化還元の「酸化数」について、勉強していきたいと思います。
「酸化数を制するものが、酸化還元を制する」と、私が勝手に言っているほど、大事な知識になります。
では、いきましょう。
まだ、酸化還元の定義が曖昧な人は、↓の記事から先に読んでくださいね。

また、化学基礎、それから上位化学(発展化学)へこれから学習を進めていく人は、次の著書がおすすめの参考書です。
本屋、またはリンクからぜひ確認してみてください。
酸化数とは
定義のところで説明があったように、現在では、酸化還元の反応は、「電子の受け渡し」と定義されています。
電子を失う反応 → 酸化反応
電子を受け取る反応 → 還元反応
ただ、化学反応の中には、反応の中での電子のやり取りがわかりにくいものがあります。
例えば、
CH4 + 2O2 → CO2 + 2H2O
このように、反応に関与する物質が全て分子の場合、何が電子を失っているのか、何が電子を受け取っているのか、わからないですね?
こういうものも、すぐに電子のやり取りがわかるようになる値、それが酸化数です。
酸化数を決めるルール
酸化数とは、物質のそれぞれの原子に当てられる値です。その値の決め方の基本ルールが次の5つになります。
①単体中の原子の酸化数は0
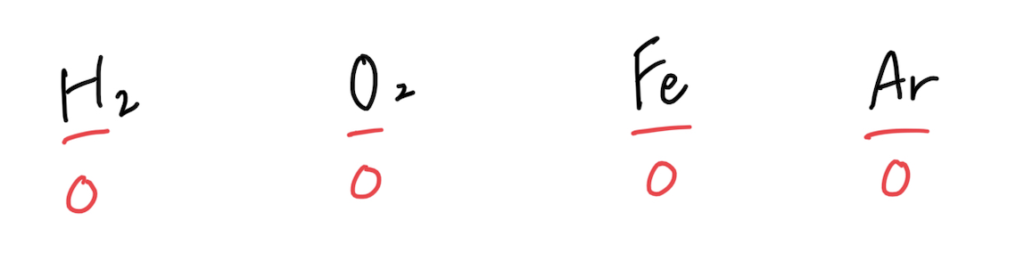
②単原子イオンの原子の酸化数は、イオンの価数に等しい
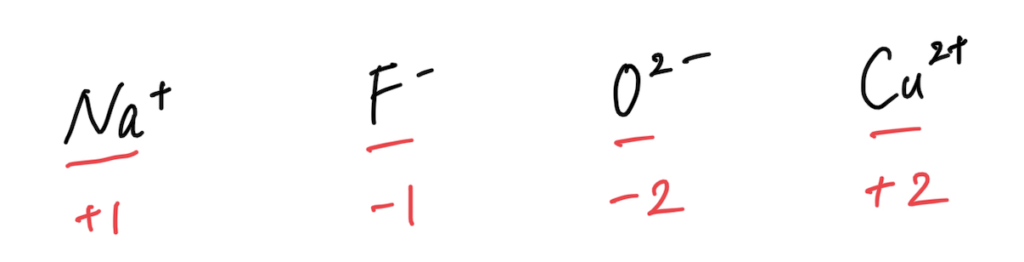
③基本的に、化合物中の水素Hの酸化数は+1、酸素Oの酸化数はー2

④化合物中の原子の酸化数の総和は0
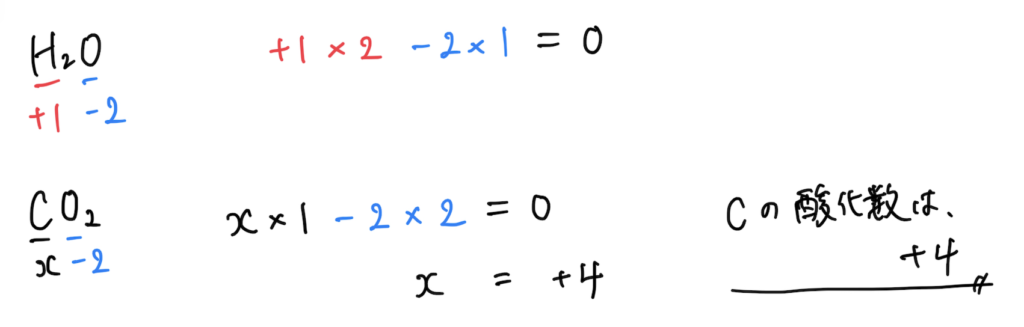
⑤多原子イオン中の原子の酸化数の総和は、イオンの価数に等しい
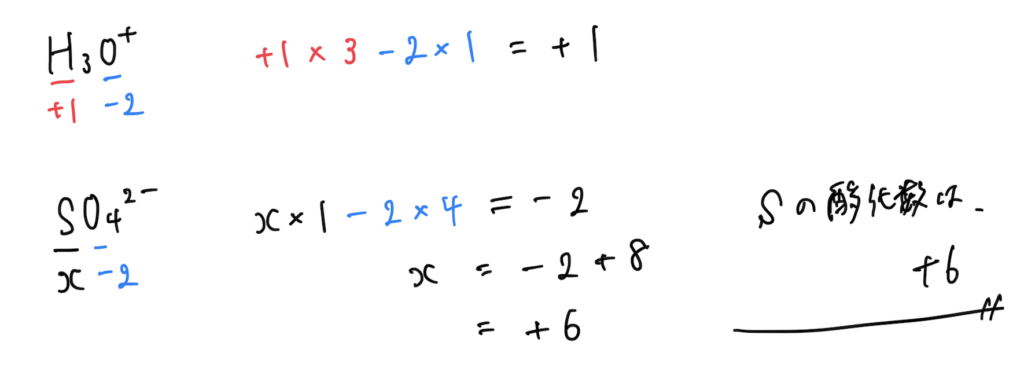
(その他、例外も含めて)
・過酸化水素H2O2の酸素の酸化数は、−1
・金属の水素化物中の水素の酸化数は、ー1
・化合物中のアルカリ金属(NaやK)は+1、アルカリ土類金属は+2
酸化数と酸化還元の関係
銅Cuと酸素O2の反応を見てみましょう。
2Cu + O2 → 2CuO
この反応の中では、酸素原子に注目すると、銅Cuが酸化され、酸素O2が還元されています。
反応式の中に、酸化数を書き加えてみると、
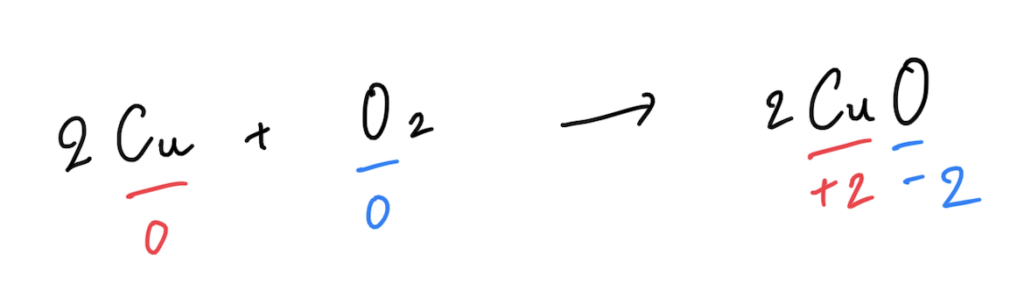
つまり、酸化されるものは酸化数が増え、還元されるものが酸化数が減る。です。
最後にこれを、電子のやり取りのわかりにくい反応に当てはめてみましょう。
CH4 + 2O2 → CO2 + 2H2O
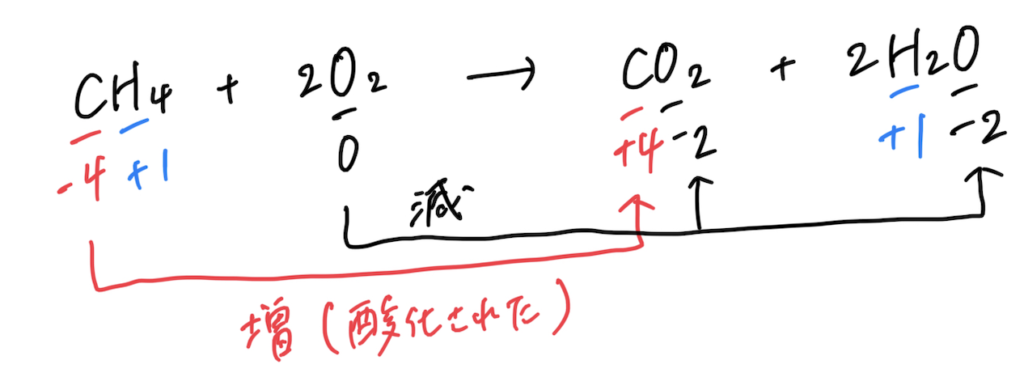
酸化数が ー4→+4に増加しているCを含むメタンCH4が酸化をされ、
酸化数が 0 → −2に減少しているOを含む酸素O2が還元される反応である。と判断できる。
最後に
このように、酸化数を利用すれば、様々な反応に対して、何が酸化され、何が還元されたのかを判断することができます。
もちろん、酸化数の増減による判断は、酸素、水素、電子の授受による定義と一切対立しないように作られていますので、心配せずにどんどん使って練習してください。
本日は以上です。
また、一緒に勉強しましょう。

コメント