今日は、化学基礎の中の4分野の一つ、酸化還元の話をしたいと思います。その1番最初、「定義」についてです。
酸化や還元とは、どういう化学変化のことをいうのか。
この問題が解決する記事になっています。
では、やっていきましょう。
酸化還元の定義
酸素Oに注目
まず最初に、酸化還元は、酸素原子Oに注目され定義されました。
酸化・・・酸素Oと化合すること
還元・・・酸素Oと離れること
*化合←原子同士がくっつくこと
です。 なので読んで字の通り、酸素と化合→酸化
酸化されたものが、酸素Oを離し、元に還る→還元
とされています。具体例は、以下の通りです。
2Cu + O2 → 2CuO
銅Cuに酸素Oがくっついて、変化後(矢印の右辺)、酸化銅CuOになっています。これが、「酸化された」ということです。
では、次の反応で酸化された物質、還元された物質はなんでしょうか。
CuO + H2 → Cu + H2O
【正解】
酸化されたもの→ H2 (Oを受け取りH2Oに)
還元されたもの→ CuO(Oが離れてCuに) となります。
水素Hに注目
せっかく「酸化・還元」という言葉を作ったのに、酸素Oの受け渡しだけでそれを定義するのは勿体無い、ということで定義を拡大するために、水素Hに注目して定義することにしたのでした。
酸化・・・水素Hと離れること
還元・・・水素Hと化合すること
です。水素に注目して定義をする場合は、酸素の場合と、くっつく(化合)・離れるが逆になっています。
酸素の定義の方が覚えやすいので、水素は「それ逆!!」と覚えましょう。
具体例
H2 + Cl2 → 2HCl
この反応の場合、
酸化されたものは、水素H2
還元されたものは、塩素Cl2になります。
H2はH原子を一つ離して、Clと結合した。 Cl2はCl原子を一つ離してHと結合した、とみます。(ちょいと複雑)
電子e–に注目
そして、最終的に「酸化・還元」の定義がたどり着いたのが、ここです。
【電子の受け渡しによる酸化・還元の定義】
現在の化学では、これにより全ての酸化・還元は定義されます。(とはいえ、ここまでの酸素、水素に注目した定義が、ここで否定されるわけではないので、どれも知っておいてください)
電子に注目して定義すると、酸化還元はこうなります。
酸化・・・電子e–が離れる(失われる)こと
還元・・・電子e–を受けとること
です。これにより、次のような反応も、酸化還元の反応に分類されるようになります。では、見てみましょう。
2Na + Cl2 →2NaCl
この反応は、酸素Oも水素Hも反応の中にないので、これまでの定義では、酸化還元に分類されませんでした。
では、なぜこれが酸化還元なのか、説明していきます。
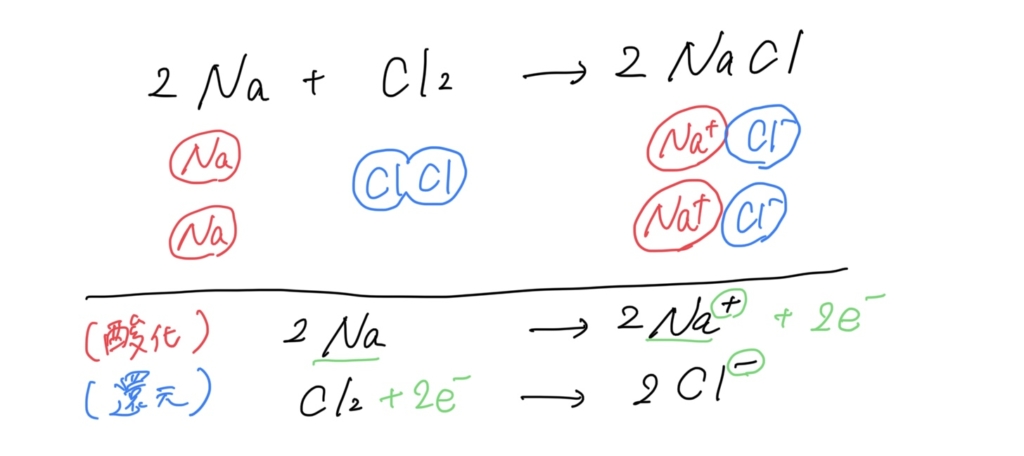
上の図は、ナトリウムNaと塩素Cl2の反応により、塩化ナトリウムNaClができる化学反応式、その下には、粒の様子を正確に書き記したものです。
この反応の中では、2つのNa原子は反応後、2つのナトリウムイオンNa+に、Cl2(塩素原子は2つ結合している)は、2つの塩化物イオンにCl–に変化しています。
イオンになったり、または原子に戻ったりという反応は、全て電子の授受によるものなので、ナトリウムは電子を失って、酸化され、塩素は電子を受け取ることにより、還元されたというようにみることができます。
酸素Oも水素Hもなくても、酸化還元反応とされる。この電子に注目した定義こそ、現代の「酸化還元反応」です。
まとめ
定義をまとめると、次のようになります。
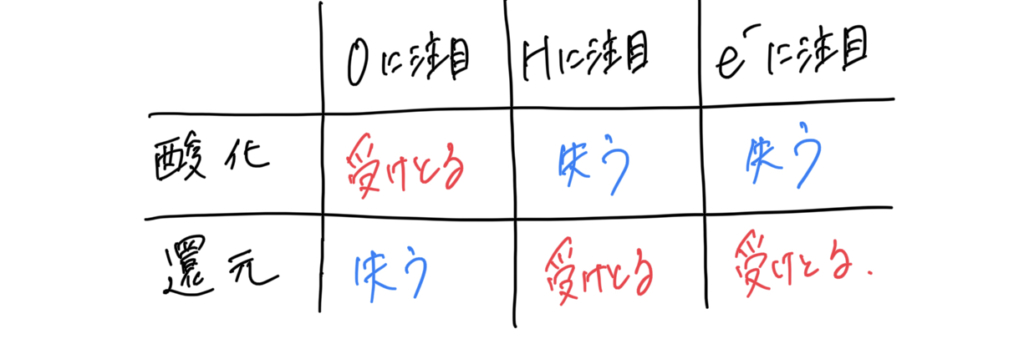
この定義をもとに、いろんな酸化還元反応を今後見ていくことになると思うので、必ず覚えておいてください。
酸素Oに注目したものが覚えやすいので、そこを覚えて、あとはその逆!です。
今回は以上になります。
また、一緒に勉強しましょう〜
Youtubeは以下のリンクから!
おやすみなさい。


コメント
コメント一覧 (2件)
[…] あわせて読みたい 化学基礎 ④酸化還元〜定義〜 今日は、化学基礎の中の4分野の一つ、酸化還元の話をしたいと思います。その1番最初、「定義」についてです。 酸化や還元とは […]
[…] https://aokuookiku.com/591/ […]