今回は、酸化還元の分野が生活にどう応用されているか、その例を紹介したいと思います。
その一つが、「電池」です。
では、今回も頑張って勉強していきましょう。
目次
電池の構造
「電池」といえば、みなさんは↓のようなものを想像すると思います。

では、その中身がどのようなつくりになっているかご存知でしょうか。
知らないですよね。だってはっきり電池に書いてますもん。
「分解しないでください」と。笑
電池の中身の構造は、最もシンプルにいうと、
2種類の金属と、電解質の水溶液
です。模式的に表すと↓ こんな感じ
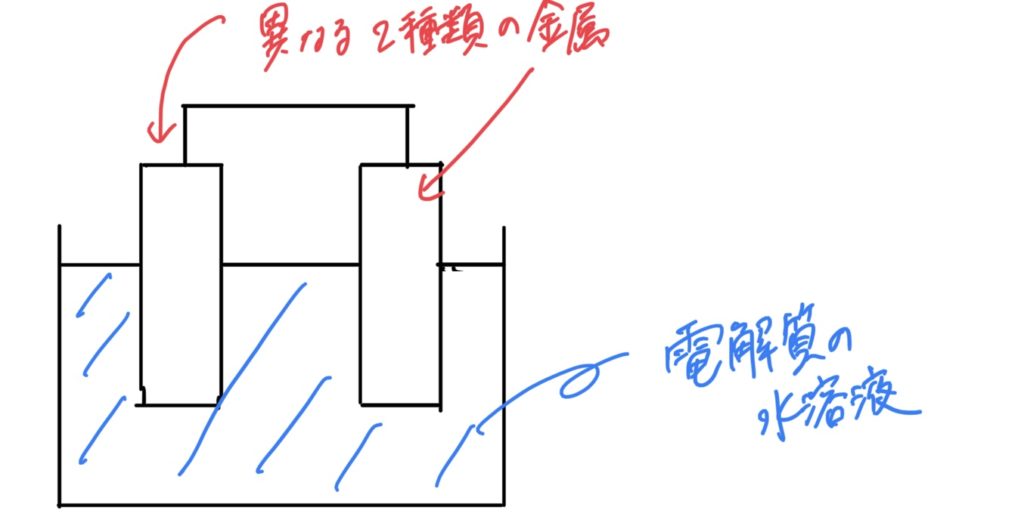
もちろん、現在実際にみなさんが使っている電池は、多くの人の努力により、より長持ちし、安全に使うために構造が複雑化されています。しかし、根本的な電池、簡易なものは、上記の構造によってつくることができます。
電解質というのは、水中でイオンに電離をするものなので、身近なものでいうと食塩(塩化ナトリウム)があります。
つまり、その辺のもので簡易な電池はつくれてしまうということです。
電池のしくみ
上記の模式的な電池の構造により、電流を発生させる(言い換えると、電子の流れを作り出す)しくみは、次のとおりになります。
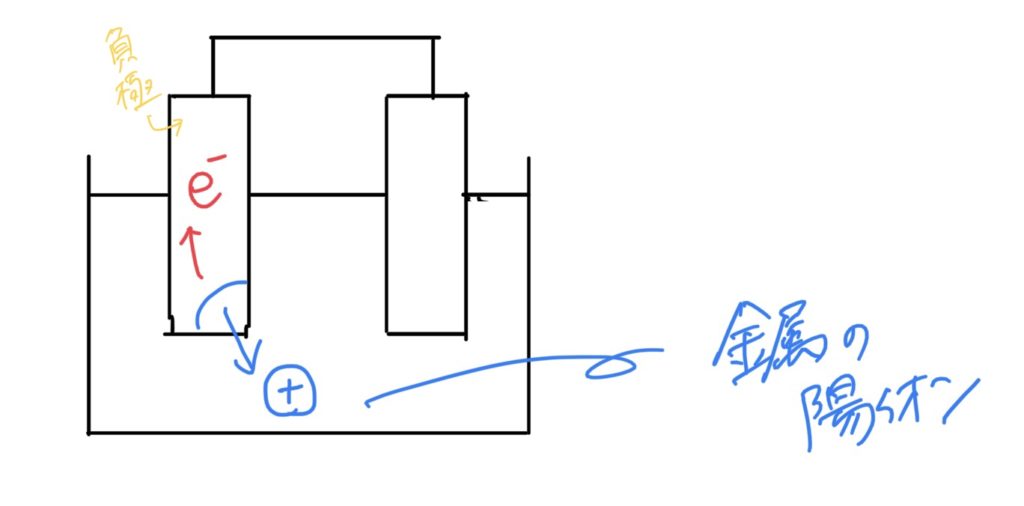
①イオン化傾向の大きな金属が、電子を放出し、イオンになる。また、こちらの電極(金属)を負極と呼ぶ。
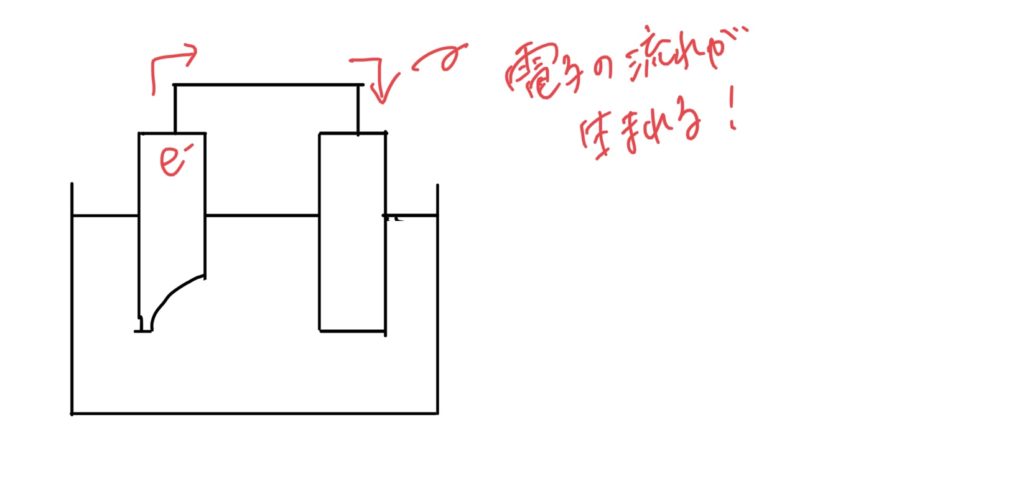
②電極に溜まった電子が、導線を通って反対側の電極へ。(電子の流れ、すなわち電流が発生)
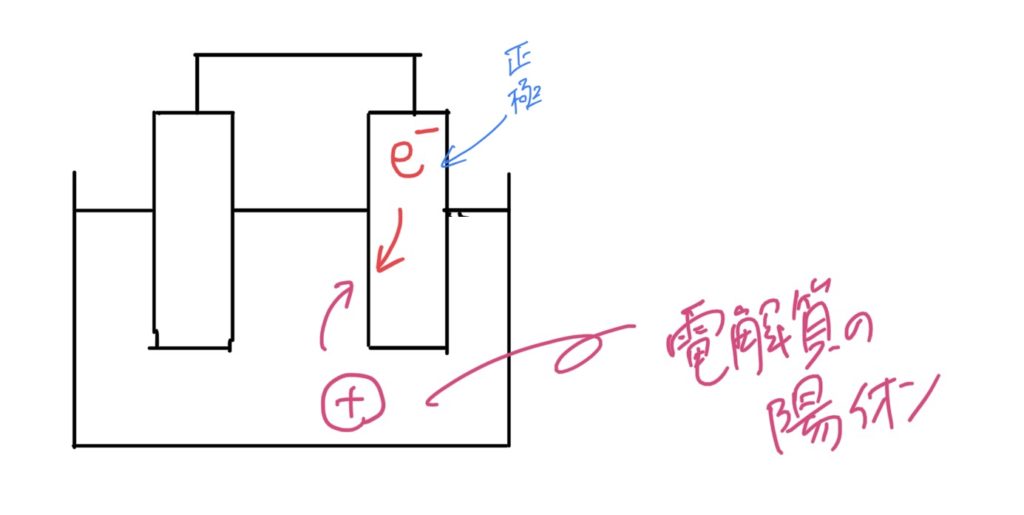
③流れてきた電子が電解質の陽イオンに受け取られる。こちらの電極を正極と呼ぶ。
電池 ポイント
負極では酸化反応、正極では還元反応が必ず起こる。
負極では電子が放出される反応(酸化)、正極では電子を受け取る反応(還元)が必ず起きます。
電子の流れは 負極 → 正極
電流は 正極 → 負極
電池の基本の基本は以上です。
お疲れ様でした。


コメント