こんにちは、aokuookikuです。
今回の記事は、「共有結合Ⅱ」ということで、↓の記事をしっかり理解してもらった上で、読んでいただきたい内容です。

ここで出てくる「電気陰性度」は、多くの現象を理解する中で、重要なキーになるものかと思います。
では、勉強していきましょう。
電気陰性度
電気陰性度とは、各原子の「電子をどのくらい強く引きつけるか」を数値化したものです。
つまりこの値が大きな原子ほど、強く電子を引きつけます。
この値は元素によって異なり、それぞれに固有の値がありますが、その値は覚える必要は全くなく、2種類を比べた時に、どちらが大きいかを判断できれば十分です。
基本的に電気陰性度は、周期表の右上ほど大きな値を取ります。ここから、大小関係がわかるようにしておきましょう。
基本的に、同族(縦の並び)では、上。同周期(横の並び)では右が大きい。

改めて共有結合を見てみる
電気陰性度を踏まえて、改めて共有結合を見てみましょう。
下の図は、塩化水素の電子式を示しています。
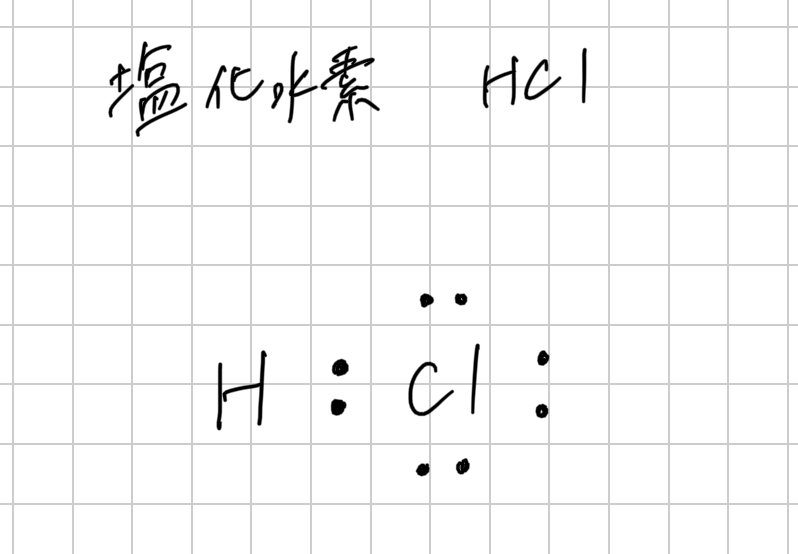
電子式の中では、共有電子対は元素記号と元素記号の間に書きますが、
電気陰性度を考慮すると、実際にちょうど真ん中にあるわけではありません。
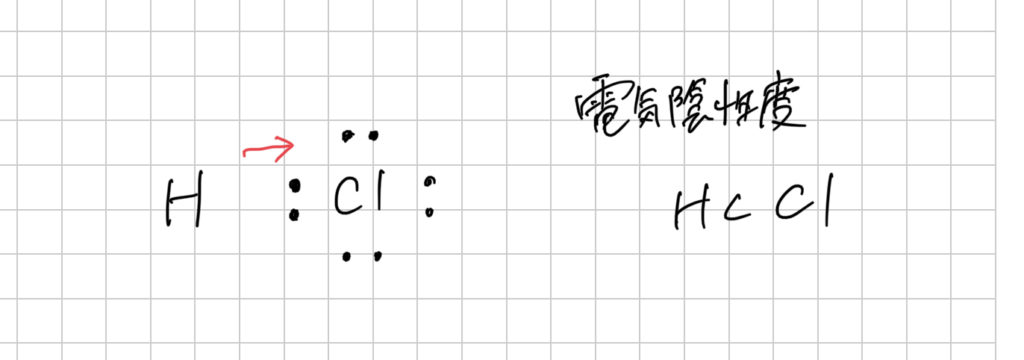
というふうに、電子が電気陰性度の大きい方の原子に偏って存在することになります。
この状態を、結合に極性があるといい、δ(デルタ)という記号で次のように表されます。

*δ(デルタ)には、「少しだけ」という意味が含まれていて、
ー(マイナス)の電気を持っている電子をひつけている方が、少しマイナスに。電子が遠ざかっている方が、少しプラスになっています、ということです。
「極性」とは、電荷に偏りがあること、であり、図のようにどちらかが+で、どちらかがーのような状態を指します。
*この極性を理解することが、その物質がどのような性質を持つかを決める、一つの大きな要素になりますが、ここでは深くは触れません。一つ簡単にあげるとするならば、なぜ水と油は混ざらないか、です。ここに極性が関わっています。
極性分子と無極性分子
分子全体として、極性があるものを極性分子、ないものを無極性分子と呼びます。
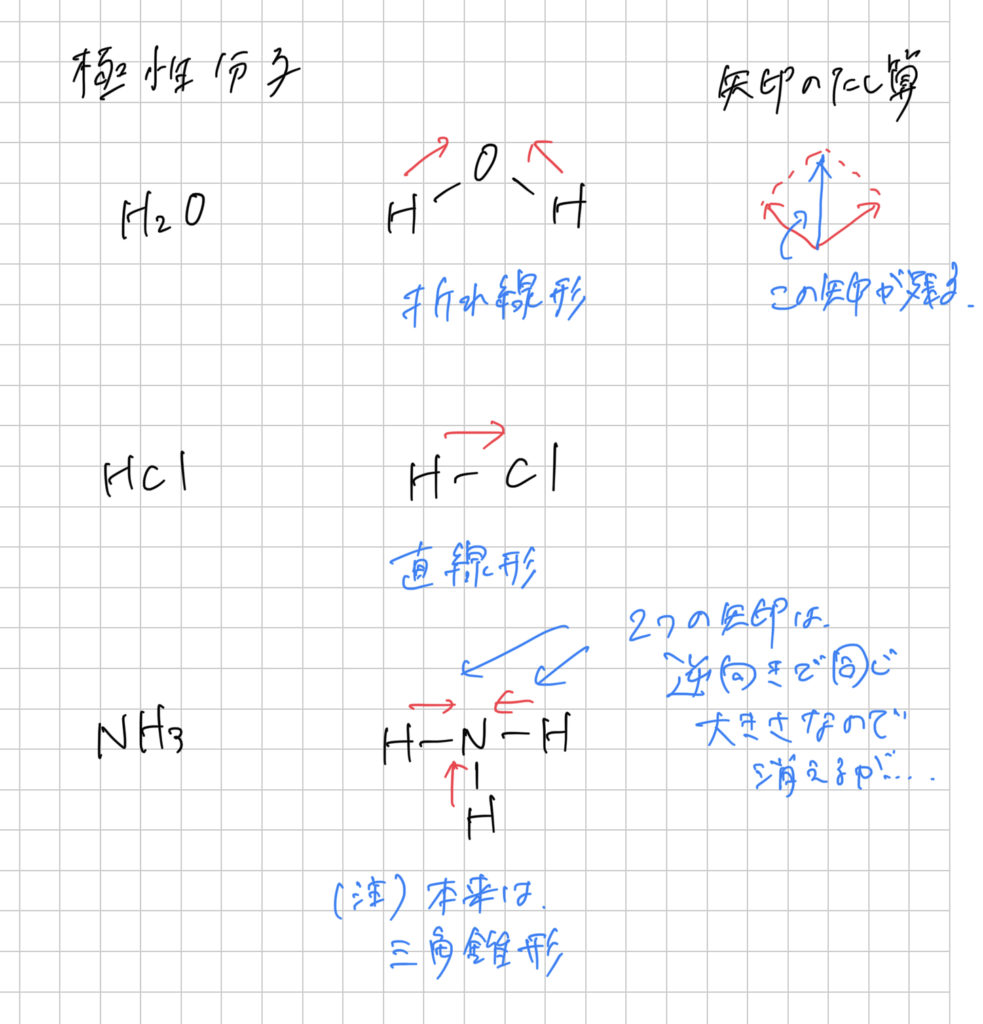
極性分子の例としては、水H2O、塩化水素HCl、アンモニアNH3などが挙げられ、
無極性分子の例としては、酸素O2、二酸化炭素CO2などが挙げられます。
極性分子か、無極性分子かの判断は、
結合に使われている電子がどちらに引っ張られているかを矢印で表し、その矢印を足し合わせることによって判断します。これは、物理の「力」のところの考え方と同じです。
足し合わせた結果、矢印が残れば極性分子、残らなければ無極性分子です。
いくつかの例を示しておきます。
分子の形も知っておく必要がありますので、教科書に載っているやつは必ず押さえておきましょう。

以上で終わります。
また一緒に勉強していきましょう!

コメント