こんにちは、aokuookikuです。だんだんと夏本番が近づいてきましたね。こまめに水分補給しましょう。
今日は、電荷を持った粒子〜イオン〜についてやっていきたいと思います。
電子配置と大きく関連付いた内容です。
まだの方はそちらからどうぞ。↓

では、いきましょう。
貴ガス
貴ガスの電子配置
イオンについて、話をする前に、貴ガスについて触れておきたいと思います。
貴ガスというのは、周期表の一番右側の列(18族)の別名で、その他の原子と比べ、
少し特別な電子配置になっています。
*貴ガスの例としては、20番までのヘリウムHe、ネオンNe、アルゴンArの3種類は確実に覚えておきましょう。
その特別さというのが、最外殻が閉殻であるということです。
「閉殻」について復習したい方もこちらから。

貴ガス(18族元素)の化学的な性質
貴ガスには、最外殻が閉殻であることによって、他の元素にはない化学的な性質があります。
その性質とは、「他の原子と結合したりせずに、原子1つで空気中に存在できる。」というものです。
これを、「化学的に安定である。」とも言います。
詳細は、また別の記事で書きますが、
原子同士は、最外殻の電子のやりとりによって、他の原子との繋がります。
しかし、貴ガスの場合は、その最外殻が閉殻、つまり閉じられているので、そのやりとりが行われず、
他原子との結合が非常に起こりにくいわけです。(高校化学まででは、起こらないと解釈して下さい)
空気中に存在する水素や窒素が2つくっついて分子として
存在(H2やN2)しているのに対し(多原子分子)、
HeやNeは1つの原子で分子のように存在しています(単原子分子)。
重要ポイント
すべての原子は貴ガス原子に憧れています!
これ、超重要ポイントです。貴ガス以外の原子が他の原子とくっついて存在するのに対し、
貴ガス原子は化学的に安定なため、1つで存在できます。
そんな貴ガスに憧れているんです。つまり同じようになりたいと思っている。
みなさんも、安定な状態にどちらかというと憧れますよね。そうなりたいと思いますよね。
気持ちや生活は安定な状態をどうしても求めるものです。それと一緒です。
イオン
イオンとはなんでしょう。
みなさんの頭におそらく最初に出てくるであろう、「フッフーン」ではありません。
イオンとは、電荷を持った粒子のことです。電荷とは+やーの電気を持つことです。
原子の構造でも勉強したように、原子中の+の電気を持った陽子と、
ーの電気を持った電子の数は同じため、+とーが打ち消し合い、電気的に中性の状態になっています。

そんな原子に、あることが起こってイオンができあがります。そのでき方を見てみましょう。
イオンのでき方
イオンは、原子中の電子が失われたり、または受け取られたりして電荷を持った粒子のことです。
持つ電気の種類によって、陽イオンと陰イオンに分けられます。

では、どんな時に電子を失ったり、得たりするのか。
そこに貴ガスの電子配置が関係してくるのです。
全ての原子は貴ガスに憧れています。貴ガスみたいになりたいんです。
そのために、自分が持つ電子を放出したり、または外からとってきて、
貴ガスと同じ電子配置になろうとします。
これがイオンができる原理です。
それぞれのイオンのでき方を下にまとめています。
陽イオン
原子が、電子を放出し、+の電気を持ったもの。
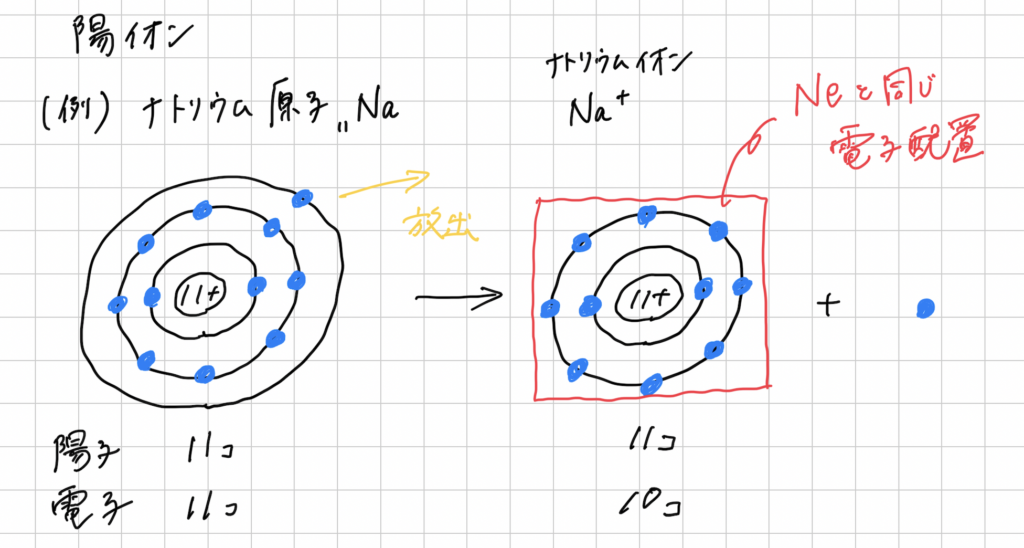
注目すべきは、陽子と電子の数です。ナトリウム原子の段階では、11こずつなので、±0。
そこから、貴ガスであるネオンNe(Naに最も原子番号の近い貴ガス)と同じ電子配置になるために電子を1つ放出します。
結果、+の陽子が1つ多くなるので、その様子をNaの元素記号の右上に+を書いて表します。
陰イオン
原子が、電子を受け取り、ーの電気を持ったもの。
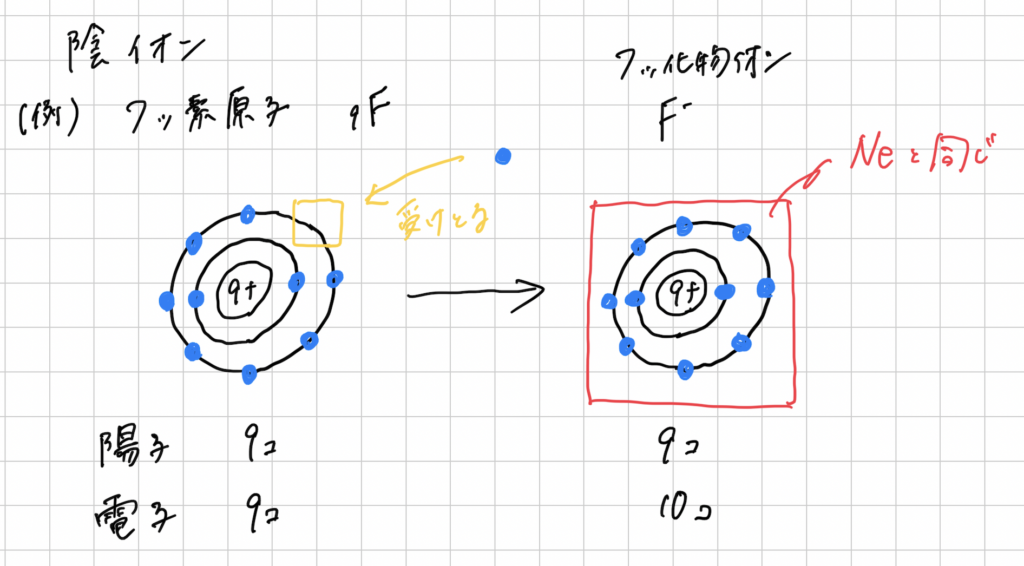
イオンの価数
原子がイオンになる際に、いくつの電子を放出、または受けっとったのか、その数を価数と呼びます。
上の例で示したナトリウムイオンやフッ化物イオンは価数 1です。これが2や3のものもあります。
(例)カルシウムイオン → Ca2+ 2価(価数2)
酸化物イオン → O2- 2価(価数2)
最後に…
イオンという粒子、それから陽イオンと陰イオンのでき方について、理解できたでしょうか。
このイオンに関する知識が、物質を決める要素の一つである結合を理解する上で大切なものです。
ここを分からないまま進むと、イオン結合のところで地獄をみます…。というか、今後の化学で…
これ以上プレッシャーかけるのはやめましょう。
知識はしっかりと積み重ねていきましょう!
ちなみに、巷で噂のマイナスイオンですが、これ何でしょうか。
ここでの学習の中からすると、陰イオンと関係ありそうですが…
陰イオンは吸い込んでもリラックス効果みたいなのがあるわけでもないですし、
むしろタンパク質を分解したり…
正確な知識を持つことは、正確な判断ができるということ。
日々一緒に勉強しましょう!
では、おやすみなさい。

コメント
コメント一覧 (1件)
[…] あわせて読みたい 化学基礎 ①基礎の化学〜イオン〜 こんにちは、aokuookikuです。だんだんと夏本番が近づいてきましたね。こまめに水分補給しましょう。 今日は、電荷を持った粒 […]