こんばんは、ただいま息子寝かしつけてきたaokuookikuです。今日は早かった!
今日は、原子の構造の3つ目「電子配置」についてやっていきたいと思います。原子の構造初心者は、ⅠとⅡから先に!


電子配置について、ピンポイントで学びたい人はこのままどうぞ。
では、スリー(Ⅲ)いきましょう!
電子配置とは
ご存知の通り、原子の構造とは次のようになっています。
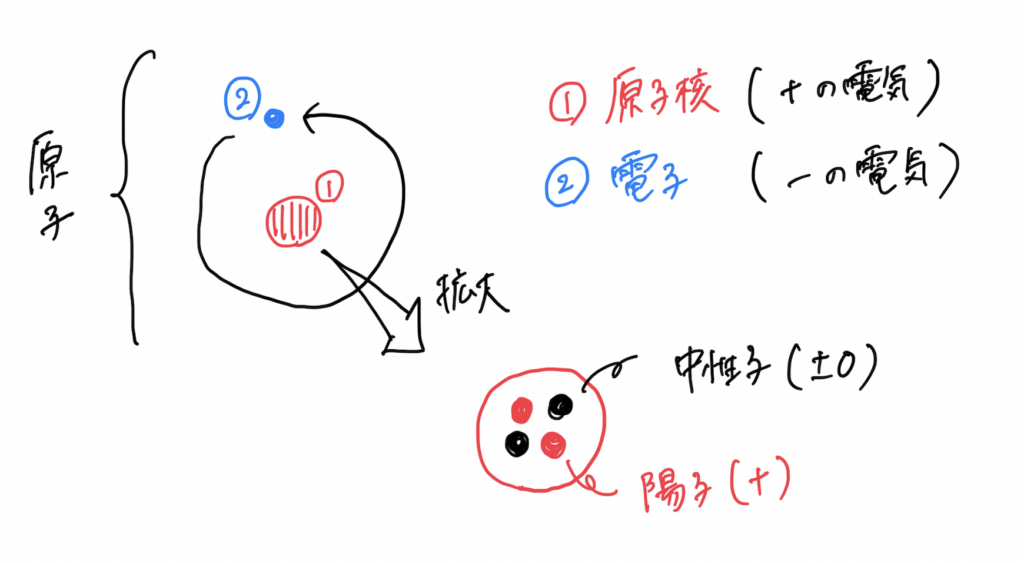
電子配置とは、原子核の周りにある電子がどのように存在しているか、を表すものです。
その原子の性質に(例えば、どんな原子とくっつきやすいか、など)関係してくる部分です。
これが物質の性質を決める重要な要素の1つ「結合」に繋がっていきます。
電子殻
原子核の周りの電子は、電子殻という部屋のようなものに入っていきます。
ただ、その電子殻という部屋には、いくつか種類があって、原子核に近いものから、
K殻、L殻、M殻、N殻・・・(この先もアルファベット順)と呼ばれています。
*余談・・・なぜKから始まっているかというと、この先、更なる研究の中で、「今の」K殻よりもさらに内側の電子殻が見つかった場合、A殻からスタートしていると「その前」がないから困ります。
K殻からスタートすることにより、一つ内側が見つかれば、J殻と名付けられる保険をかけているということです。(余談終わり)
電子殻のイメージは次のような感じ↓
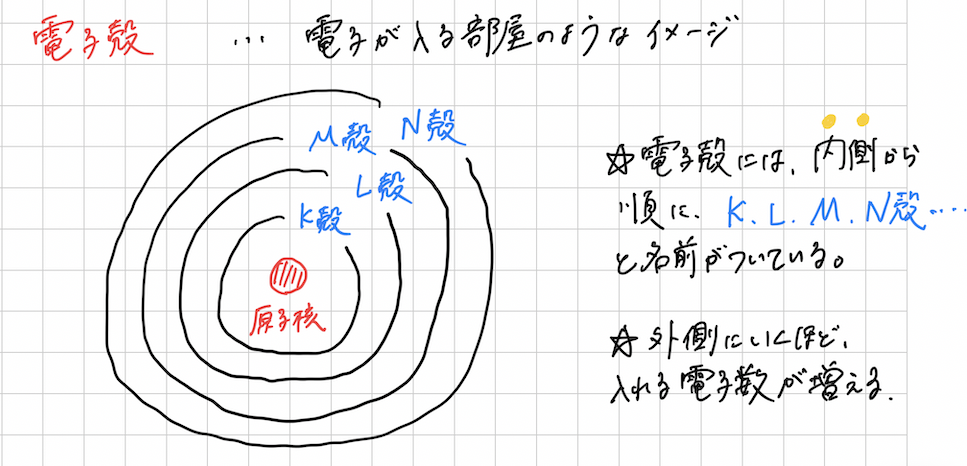
イメージを見てもわかるように、外に広がるほど、円も大きくなっていっていますよね。つまり電子殻という部屋が大きくなっているということなので、そこに入れる電子の数も次第に増えていきます。
入れる電子の数(最大収容数)は、次の通りです。

電子配置を書くときのルール
では、どのように電子配置を書いていくのか。
絶対に外してはいけないルールを2つ押さえておいてください。その2つとは、
①電子は内側の電子殻から順に配置されていく。
②電子殻の最大収容数を超えて、電子は配置されない。
です。
まず、①ですが、中心の原子核は+の電気を持っています。それに対して、電子は?・・・
そうーの電気を持っています。つまり、電子は原子核のことが好きです!!(なぜなら+とーは引き合う運命だから!同じ符号は反発する運命だから!)
なので、電子はなるべく原子核の近くにいたいので、なるべく内側の電子殻に入ろうするわけです。
ただ、電子殻には、入れる電子の数に限りがあるので(最大収容数)、部屋がいっぱいになると、一つ外側の電子殻に入ることになります。
このとき、②が適応されます。満タンのところには、それ以上無理矢理にでも入ることはできません。
この2つのルールを頭に置きながら、実際に電子配置を書いてみましょう。
電子配置、書いてみる
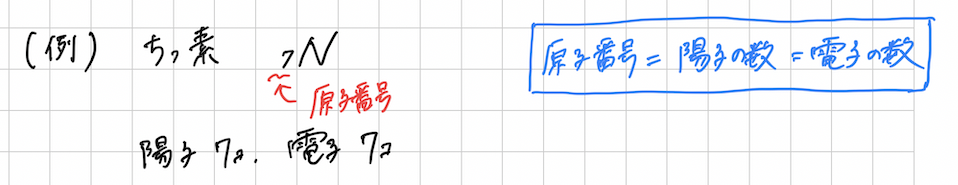
例えとして、ちっ素原子Nの電子配置を書いてみたいと思います。
書くまえに、電子の数を確認しましょう。電子がどう配置されるかが電子配置。なら、その電子の個数を把握するのがまず先です。
各原子の電子の数は次のように、求められます。
ではいきます。
①まず中心となる原子核を書きます。このとき、原子核中にある陽子の数を考慮して、次のように表記する場合が多いです。

②次に、内側から順に電子を配置していきます。K殻からです。(青い点が電子)

K殻には2つまでしか入れないので、3つ目の電子は次のL殻にいくわけですが、
何人か疑問に思っている人がいそうなので、少しそこに触れておくと、
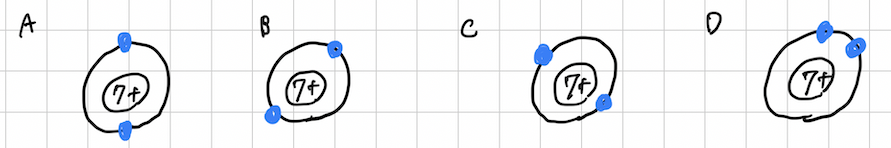
②にある様子以外に、A〜Dのような書き方(電子の場所)でも、間違ってはいません。
「K殻に2つの電子」という点では、電子配置的には合っている表記だからです。ただ、Dはやめておいた方がいいと思います。
電子は−の電気を持つので、互いに反発するはずです。なので、なるべく距離をとります。
Dの様子は、化学屋からすると気持ち悪いです、、、。採点の先生が体調悪くなるかもしれません。やめておきましょう。
③K殻に2つ入ったので、残りの5つをL殻に配置しましょう。
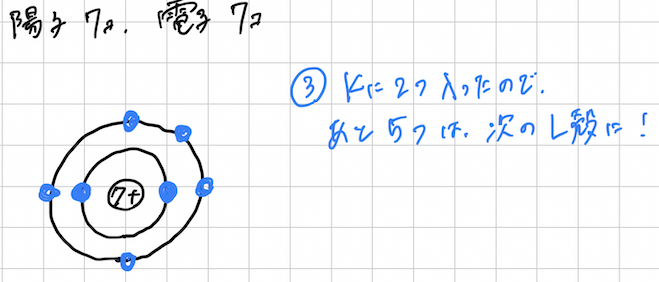
これでちっ素の電子配置が完成です。

他の原子も使って繰り返し練習し、自力で書けれるようにしておいてください。
重要語句
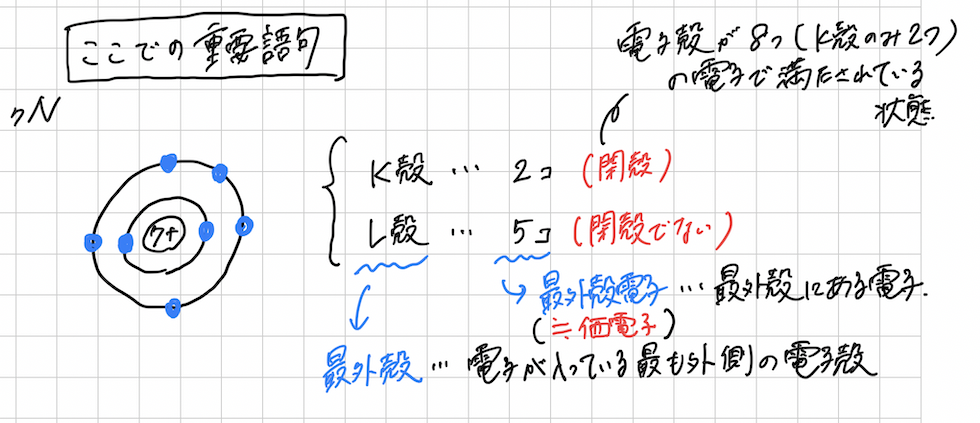
最後に、電子配置に関係する重要語句をまとめておきます。
・閉殻・・・電子殻が8つの電子で満たされている状態。(K殻のみ2つ)
・最外殻・・・その電子配置の中で、電子が存在する最も外側の電子殻
・最外殻電子(≒価電子)・・・最外殻にある電子
☆最外殻電子と価電子が=ではなく、≒なのは、ある条件のときのみ扱い方が少し変わるからです。
その条件とは、「最外殻が閉殻」であるときです。この時だけは、最外殻電子と価電子は同じ意味ではなくなります。注意!

電子配置については以上です。
「結合」につながる重要な部分!ばっちりにしておいてください。
Youtubeは以下のリンクから!
では、おやすみなさい。

コメント
コメント一覧 (2件)
[…] 化学基礎 no.6 ①基礎の化学〜原子の構造Ⅲ 電子配置〜 2021年7月14日 […]
[…] あわせて読みたい 化学基礎 ①基礎の化学〜原子の構造Ⅲ 電子配置〜 こんばんは、ただいま息子寝かしつけてきたaokuookikuです。今日は早かった! 今日は、原子の構造の3つ目「 […]